Medir el estado metabólico de las células asegura que un cultivo de levadura sea capaz de catalizar las reacciones asociadas con la fermentación y sobrevivir adecuadamente a los duros ambientes del mosto y la cerveza.
Contenido
Viabilidad vs. vitalidad
Mientras que la viabilidad es una medida de las células vivas en un cultivo, la vitalidad es una medida del estado metabólico de estas células.
Por lo tanto, examinar la vitalidad de un cultivo de levadura puede prevenir muchos de los problemas comunes durante la elaboración de cerveza, como fermentaciones estancadas, baja atenuación y aromas o sabores desagradables derivados de la levadura.
Estrategias para determinar la vitalidad
Generalmente, los ensayos de vitalidad miden la actividad enzimática intracelular o la presencia de componentes celulares críticos para la supervivencia.
Uno de los ensayos más comunes disponibles comercialmente para medir la vitalidad utiliza un tinte fluorescente llamado CFDA-AM para teñir las células con enzimas esterasas funcionales.
El CFDA-AM (5-carboxyfluorescein diacetate, acetoxymethyl ester) es un tinte fluorogénico permeable a las células utilizado en estudios de citotoxicidad y viabilidad celular. Este compuesto es no fluorescente y puede ingresar a las células vivas, donde las esterasas intracelulares hidrolizan el éster acetoximetilo, liberando carboxifluoresceína fluorescente. Esta fluorescencia sirve como un indicador de actividad enzimática y de la integridad de la membrana celular, lo que lo convierte en una herramienta útil para evaluar la salud y viabilidad celular en diversas aplicaciones biológicas y bioquímicas.
Este tinte en particular es hidrolizado por enzimas esterasas intracelulares después de su difusión pasiva en las células de levadura.
La presencia de la tinción fluorescente en la célula indica que las células no solo están vivas sino que también son capaces de catalizar reacciones metabólicas.
Reacciones metabólicas
Las reacciones metabólicas que ocurren dentro de las células de la levadura son las que transforman el mosto en cerveza y su medición directa puede ser utilizada para predecir el rendimiento de la fermentación de un cultivo.
La intensidad a la que una célula fluoresce está directamente relacionada con la hidrólisis de la tinción CFDA-AM, por lo que algunas muestras contendrán una mezcla de células con intensidad de fluorescencia variable (Figura 1).
Luego, son varios los factores que influyen en la intensidad de la fluorescencia, incluida la concentración del tinte utilizado, la temperatura de incubación, la duración de la incubación, el pH intracelular y el flujo de salida de las sondas fluorescentes.
La mayoría de estas variables están controladas por las condiciones del ensayo y el principal factor que influye en la intensidad de la fluorescencia será la actividad esterasa intracelular.
Investigaciones anteriores realizadas con este ensayo por Chan et al. (2012) utilizaron el valor de la intensidad de la fluorescencia para calcular el porcentaje de células de alta fluorescencia cuantificando así la vitalidad del cultivo celular y poder realizar comparaciones.
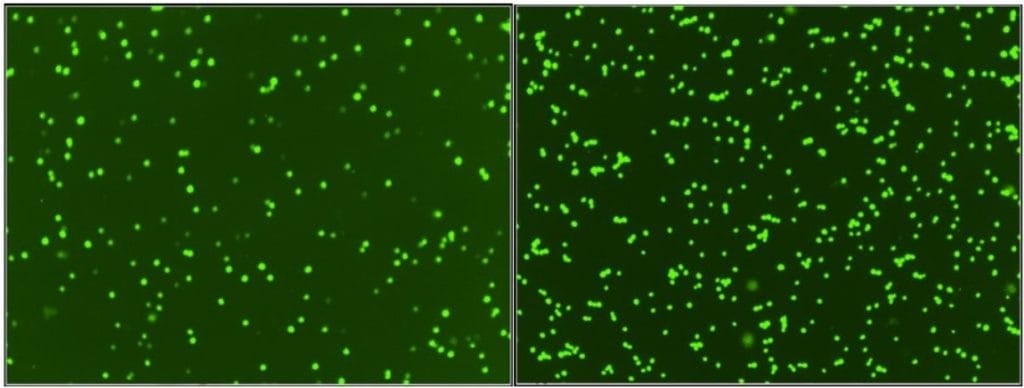
Para demostrar el cambio en el porcentaje de células de alta fluorescencia, el laboratorio de investigación de Wyeast realizó un análisis de vitalidad en siete lotes de 1056 American Ale® almacenados durante períodos de tiempo variables a 1,6 °C (35 °F) (Figura 2).
Para la muestra 1056 American Ale® almacenada durante 6 días, la visualización de la intensidad de la fluorescencia celular con un histograma revela un peak definido entre 60 y 160 recuentos de intensidad (Figura 2a).
Después de períodos más largos de almacenamiento, el peak se aplana y evoluciona hacia valores de intensidad más bajos debido a una reducción en la actividad esterasa celular, lo que representa una disminución en la vitalidad del cultivo (Figura 2b-g).
Una estrategia para cuantificar esta disminución es utilizar el valor de intensidad donde comienza el peak en la muestra después de 6 días de almacenamiento.
La flecha de la Figura 2a muestra este valor en 60 recuentos, el cual puede utilizarse como valor crítico para calcular el porcentaje de células de alta fluorescencia en cada muestra de 1056 American Ale®.
La ecuación para este cálculo de vitalidad sería:
Vitalidad (%) = Número de células con intensidad de fluorescencia por encima del valor crítico / Número total de células
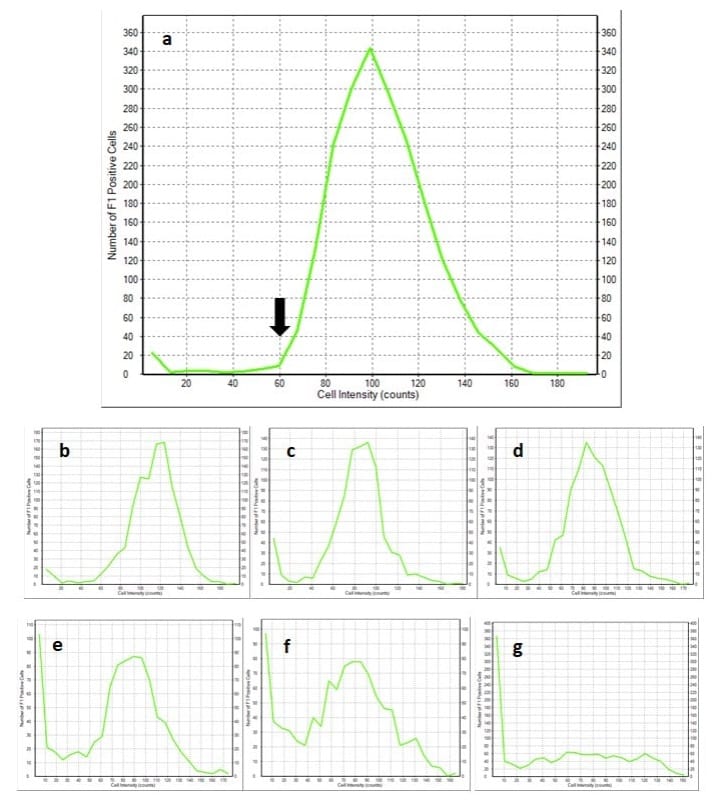
Cada histograma es el resultado de analizar un lote único de levadura con la tinción fluorescente CFDA-AM.
La flecha en el histograma de la levadura almacenada durante 6 días después de la propagación muestra el valor crítico para las células de alta fluorescencia.
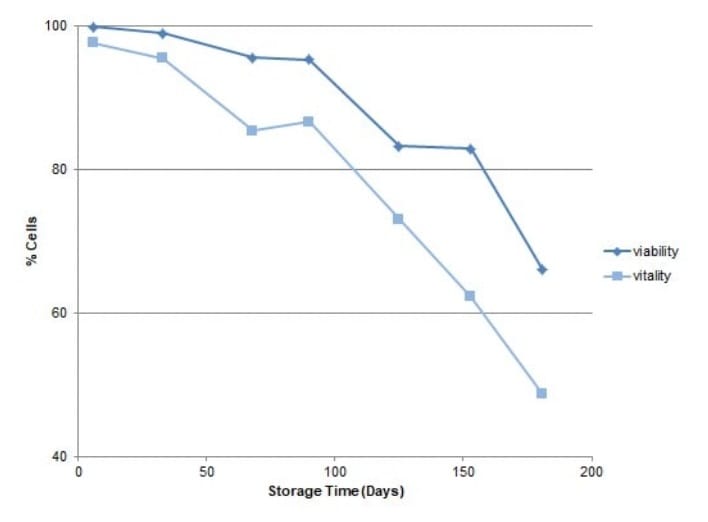
Calcular el porcentaje de células de alta fluorescencia en cada muestra revela una disminución de la vitalidad con el tiempo (Figura 3).
Si bien este es un resultado esperado, representar gráficamente la vitalidad junto con la viabilidad demuestra su sensibilidad y valores de medición.
Durante los 180 días de almacenamiento, la vitalidad disminuyó del 97,7 % al 48,6 % mientras que la viabilidad disminuyó del 99,9 % al 66,0 %.
La diferencia en las dos mediciones durante un período más corto de dos meses de almacenamiento muestra un cambio de vitalidad casi tres veces mayor, con una caída de vitalidad del 12,3% en comparación con una caída del 4,3% en la viabilidad.
Los cultivos de levadura viva normalmente se almacenan durante períodos cortos de tiempo y como fabricante, esto suele ser cuestión de días o semanas. Lo mismo ocurre con las cervecerías.
Por lo tanto, el ensayo de vitalidad es un ensayo más sensible e informativo que el de viabilidad para detectar cambios en un cultivo de levadura.
El método para cuantificar la vitalidad descrito aquí es un procedimiento rápido que proporciona una comprensión más completa de la idoneidad de un cultivo celular para su uso en una fermentación de cerveza.
Control de calidad
La medición de la vitalidad permite al equipo de laboratorio detectar pequeñas diferencias entre cultivos mientras se realizan controles de calidad durante el trabajo de investigación y desarrollo.
Esta información luego se puede aplicar al proceso de propagación para refinar la salud de la levadura, la estabilidad y el rendimiento de la fermentación del cultivo.
Con avances como este en la ciencia de la levadura y la fermentación, es posible garantizar que los productos sean sometidos a fermentaciones exitosas de manera confiable en la sala de cocción, lo que dará como resultado cervezas de alta calidad.
Referencias
- Magdalena, K. and Renata Z. 2014. Comparison of methods used for assessing the viability and vitality of yeast cells. FEMS Yeast Research 14: 1068-1079.
- Breeuwer, P.; Drocourt, J.; Bunschoten, N.; Zwietering, M.; Rombouts, F.; Abee, T. 1995. Characterization of Uptake and Hydrolysis of Fluorescein Diacetate and Carboxyfluorescein Diacetate by Intracellular Esterases in Saccharomyces cerevisiae, Which Result in Accumulation of Fluorescent Product. Applied and Environmental Microbiology 61(4): 1614-1619.
- Chan, L.; Kury, A.; Wilkinson, A.; Berkes, C.; Pirani, A. 2012. Novel image cytometric method for detection of physiological and metabolic changes in Saccharomyces cerevisiae. Journal of Industrial Microbiology and Biotechnology 39: 1615-1623.
Recomendamos
- Orval Belgian Pale Ale: Notas de cata y maridajes recomendados
- Bierstacheln: La técnica alemana de “pinchar” y caramelizar la cerveza